- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA CHƯƠNG I – BÀI 1 : TÍNH CHẤT HÓA HỌC CỦA OXIT. KHÁI QUÁT VỀ SỰ PHÂN LOẠI OXIT
- GIẢI BÀI TẬP HÓA 9 CHƯƠNG I – BÀI 2 MỘT SỐ OXIT QUAN TRỌNG
- GIẢI BÀI TẬP HÓA 9 CHƯƠNG I – BÀI 3 TÍNH CHẤT HÓA HỌC CỦA AXIT
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA CHƯƠNG I – BÀI 4 MỘT SỐ AXIT QUAN TRỌNG
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 5 LUYỆN TẬP: TÍNH CHẤT CỦA OXIT VÀ AXIT
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 6 THỰC HÀNH : TÍNH CHẤT HÓA HỌC CỦA OXIT VÀ AXIT
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 8 MỘT SỐ BAZO QUAN TRỌNG
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 7 TÍNH CHẤT HÓA HỌC CỦA BAZO
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 9 TÍNH CHẤT HÓA HỌC CỦA MUỐI
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 10 MỘT SỐ MUỐI QUAN TRỌNG
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 12 MỐI QUAN HỆ GIỮA CÁC HỢP CHẤT VÔ CƠ
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 11 PHÂN BÓN HÓA HỌC
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 13 LUYỆN TẬP CHƯƠNG I CÁC HỢP CHẤT VÔ CƠ
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 15 TÍNH CHẤT VẬT LÝ CỦA KIM LOẠI
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 16 TÍNH CHẤT HÓA HỌC CỦA KIM LOẠI
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 14 TÍNH CHẤT HÓA HỌC CỦA BAZO VA MUỐI
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 17 DÃY HOẠT ĐỘNG HÓA HỌC CỦA KIM LOẠI
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 18 NHÔM
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 19 SẮT
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 20 HỢP KIM SẮT : GANG THÉP
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 21 SỰ ĂN MÒN KIM LOẠI VÀ BẢO VỆ KIM LOẠI KHÔNG BỊ ĂN MÒM
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 22 LUYỆN TẬP CHƯƠNG II : KIM LOẠI
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 23 THỰC HÀNH TÍNH CHẤT HÓA HỌC CỦA NHÔM VÀ SẮT
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 24 ÔN TẬP HỌC KỲ 1
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 25 TÍNH CHẤT CỦA PHI KIM
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 26 CLO
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 27 CACBON
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 28 CÁC OXIT CỦA CÁCBON
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 29 AXIT CACBONIC VÀ MUỐI CACBONAT
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 30 SILIC. CÔNG NGHIỆP SILICAT
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 31 SƠ LƯỢC VỀ BẢNG TUẦN HOÀN HÓA HỌC
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 32 LUYỆN TẬP CHƯƠNG 3 PHI KIM. SƠ LƯỢC VỀ BẢNG TUẦN HOÀN HÓA HỌC
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 34 KHÁI NIỆM VỀ HỢP CHẤT HỮU CƠ VÀ HÓA HỌC HỮU CƠ
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 33 THỰC HÀNH: TÍNH CHẤT HÓA HỌC CỦA PHI KIM VÀ HỢP CHẤT CỦA CHÚNG
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 36 METAN
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 35 CẤU TẠO PHÂN TỬ HỢP CHẤT HỮU CƠ
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 38 AXETILEN
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 39 BENZEN
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 37 ETILEN
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 41 NHIÊN LIỆU
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 42 LUYỆN TẬP CHƯƠNG 4; HIDROCACBON – NHIÊN LIỆU
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 43 THỰC HÀNH TÍNH CHẤT CỦA HIDROCACBON
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 44 RƯỢU ETYLIC
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 45 AXIT AXETIC
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 46 MỐI LIÊN HỆ GIỮA ETILEN, RƯỢU ETYLIC VÀ AXIT AXETIC
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 47 CHẤT BÉO
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 48 LUYỆN TẬP: RƯỢU ETYLIC, AXIT AXETIC VÀ CHẤT BÉO
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 49: THỰC HÀNH: TÍNH CHẤT CỦA RƯỢU VÀ AXIT
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 50 GLUCOZO
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 51 SACCAROZO
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 52 TINH BỘT VÀ XENLULOZO
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 53 PROTEIN
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 54 POLIME
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 55 THỰC HÀNH: TÍNH CHẤT CỦA GLUXIT
- GIẢI BÀI TẬP HÓA 9 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 56 ÔN TẬP CUỐI NĂM
Bài 32: Luyện tập chương 3: Phi kim – Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Bài 1: Căn cứ vào sơ đồ sau:

Hãy viết phương trình hóa học với phi kim cụ thể là lưu huỳnh.
Lời giải:
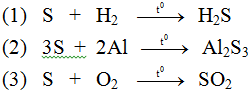
Bài 2: Hãy viết các phương trình hóa học biểu diễn tính chất hóa học của clo theo sơ đồ sau:

Lời giải:

(4) Cl2(k) + H2O(l) ↔ HCl(dd) + HClO(dd)
Bài 3: Hãy viết các phương trình hóa học biểu diễn tính chất hóa học của cacbon và một số hợp chất của nó theo sơ đồ 3. Cho biết vai trò của cacbon trong phản ứng đó.
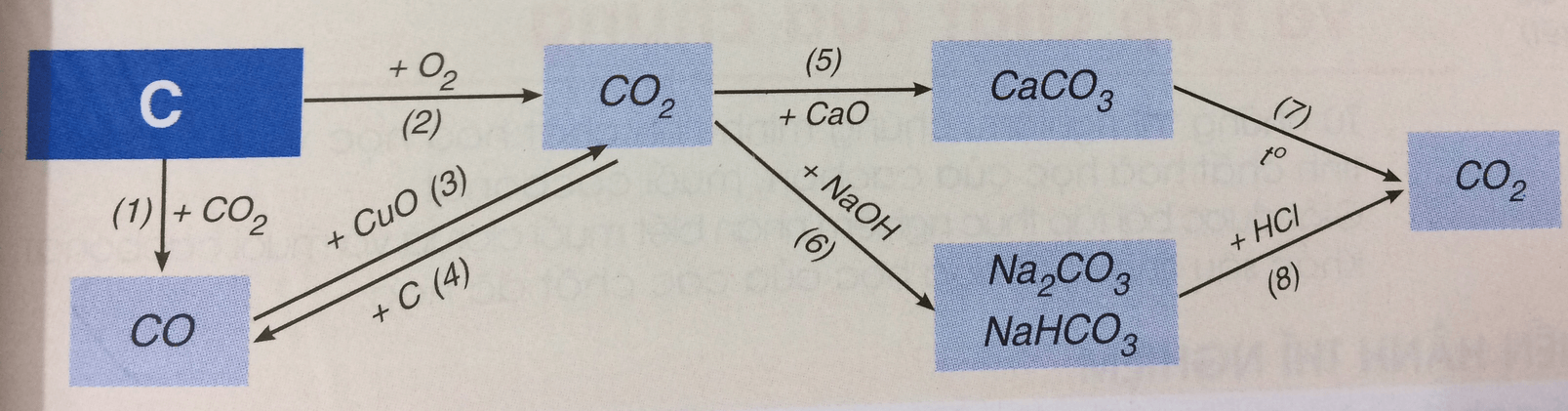
Lời giải:
PTHH biểu diễn tính chất hóa học của cacbon và một số hợp chất khác:
(1) C(r ) + CO2(k) to→ 2CO(k)
(2) C(r ) + O2(k) to→ CO2(k)
(3) 2CO(k) + O2(k) to→ 2CO2(k)
(4) CO2(k) + C(r ) to→ 2CO(k)
(5) CO2(k) + CaO(r ) to→ CaCO3(r )
(6) CO2(k) + 2NaOH(dd) → Na2CO3(r ) + 2H2O(l)
(7) CaCO3(r ) to→ CaO(r ) + CO2(k)
(8) Na2CO3(r ) + 2HCl(dd) to→ 2NaCl(dd) + CO2(k)↑ + H2O(l)
Bài 4: Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm I trong bảng hệ thống tuần hoàn. Hãy cho biết:
– Cấu tạo nguyên tử của A.
– Tính chất hóa học đặc trưng của A.
– So sánh tính chất hóa học của A với các nguyên tố lân cận.
Lời giải:
a) Cấu tạo nguyên tử của A:
Số hiệu nguyên tử của A là 11 cho biết: natri ở ô số 11, điện tích hạt nhân nguyên tử natri là 11+ có 11 electron trong nguyên tử natri, ở chu kì 3, nhóm I.
b) Tính chất hóa học đặc trưng của natri:
Nguyên tố natri ở đầu chu kì là hai kim loại mạnh, tròn phản ứng hóa học, natri là chất khử mạnh.
Tác dụng với phi kim:
4Na + O2 → 2Na2O
2Na + Cl2 → 2NaCl
Tác dụng với dung dịch axit:
2Na + 2HCl → 2NaCl + H2 ↑
Tác dụng với nước: Nguyên tố Na ngoài tính chất hóa học chung của kim loại còn có tính chất hóa học đặc trưng là tác dụng với H2O ở nhiệt độ thường.
2Na + 2H2O → 2NaOH + H2 ↑
Tác dụng với dung dịch muối: Na + dung dịch CuSO4
2Na + 2H2O → 2NaOH +H2 ↑
2NaOH + CuSO4 → Cu(OH)2 ↓ +Na2SO4
c) So sánh tính chất hóa học của Na với các nguyên tố lân cận:
Na có tính chất hóa hoc mạnh hơn Mg (nguyên tố sau Na), mạnh hơn Li (nguyên tố trên Na) nhưng yếu hơn K (nguyên tố dưới Na).
Bài 5: a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32g oxit sắt này tác dụng hoàn toàn với khí cacbon oxit thì thu được 22,4g chất rắn.
b) Chất khí sinh ra được hấp thụ hoàn toàn trong dung dịch nước vôi trong có dư. Tính khối lượng kết tủa thu được.
Lời giải:
a) Gọi công thức của oxit sắt là: FexOy
PTHH: FexOy + yCO → xFe + yCO2 (1)
1 mol y mol x mol y mol
0,4/x 0,4 mol
nFe = 22,4 / 56 = 0,4 (mol)
Theo pt: nFexOy = 0,4 / x (mol)
mFexOy = (56x + 16y). 0,4/x = 32 ⇒ x : y = 2 : 3
⇒ CT của oxit sắt (Fe2O3)n
↔ (56.2 + 16.3)n = 160 ⇒ n = 1.
Vậy CTHH của oxit sắt: Fe2O3.
b) Khí sinh ra CO2
PTHH: Fe2O3 + 3CO → 2Fe + 3CO2 (1)
CO2 + Ca(OH)2 → CaCO3↓ + H2O (2)
1 mol 1 mol 1 mol 1 mol
0,6 mol
Theo pt (1) : nCO2 = (3/2). nFe = (0,4.3) / 2 = 0,6 (mol)
Theo pt (2) ⇒ nCaCO3 = nCO2 = 0,6 (mol)
mCaCO3 = 0,6.100 = 60 (g).
Bài 6: Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dẫn khí X vào 500ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Lời giải:
nMnO2 = 69,6 / 87 = 0,8 mol.
VNaOH = 500ml = 0,5 lít ⇒ nNaOH = CM. V= 0,5 x 4 = 2 mol.
Phương trình phản ứng:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.
Theo pt: nCl2 = nMnO2 = 0,8 mol.
Cl2 + 2NaOH → NaCl + NaClO + H2O.
Ta có tỉ lệ: 0,8/1 < 2/2 → NaOH dư nên tính nNaCl và nNaClO theo nCl2
Theo pt: nNaCl = nNaClO = nCl2 = 0,8 mol.
CM(NaCl)= CM(NaClO) = 0,8 / 0,5 = 1,6 mol/l.
Theo pt: nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6mol.
CM(NaOH) dư = (2 – 1,6) / 0,5 = 0,8 mol/l.
