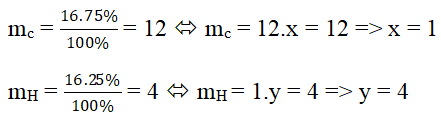- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 1 MỞ ĐẦU MÔN HÓA HỌC
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 2 CHẤT
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 3 BÀI THỰC HÀNH 1 – TÍNH CHẤT NÓNG CHẢY CỦA CHẤT – TÁCH CHẤT TỪ HỖN HỢP
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 4 NGUYÊN TỬ
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 5 NGUYÊN TỐ HÓA HỌC
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 6 ĐƠN CHẤT VÀ HỢP CHẤT – PHÂN TỬ
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 8 BÀI TẬP LUYỆN TẬP 1
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 9 CÔNG THỨC HÓA TRỊ
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 7 BÀI THỰC HÀNH 2
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 10 HÓA TRỊ
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 11 BÀI LUYỆN TẬP 2
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 12 SỰ BIẾN ĐỔI CHẤT
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 13 PHẢN ỨNG HÓA HỌC
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 14 BÀI THỰC HÀNH 3
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 15 ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 16 PHƯƠNG TRÌNH HÓA HỌC
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 17 BÀI LUYỆN TẬP 3
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 18 MOL
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 19 CHUYỂN ĐỔI GIỮA KHỐI LƯỢNG THỂ TÍCH VÀ LƯỢNG CHẤT
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 20 TỶ KHỐI CỦA CHẤT KHÍ
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 21 TÍNH THEO CÔNG THỨC HÓA HỌC
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 22 TÍNH THEO PHƯƠNG TRÌNH HÓA HỌC
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 23 BÀI LUYỆN TẬP 4
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 25 SỰ OXI HÓA – PHẢN ỨNG HÓA HỢP – ỨNG DỤNG CỦA OXI
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 24 TÍNH CHẤT CỦA OXI
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 26 OXIT
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 27 ĐIỀU CHẾ OXI – PHẢN ỨNG PHÂN HỦY
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 29 BÀI LUYỆN TẬP 5
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 30 BÀI THỰC HÀNH 4
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 28 KHÔNG KHÍ – SỰ CHÁY
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 31 TÍNH CHẤT – ỨNG DỤNG CỦA HIDRO
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 32 PHẢN ỨNG OXI HÓA KHỬ
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 33 ĐIỀU CHẾ KHÍ HIDDRO – PHẢN ỨNG THẾ
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 34 BÀI LUYỆN TẬP 6
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 35 BÀI THỰC HÀNH 5
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 36 NƯỚC
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 37 AXIT – BAZO – MUỐI
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 38 BÀI LUYỆN TẬP 7
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 39 BÀI THỰC HÀNH 6
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG VI – BÀI 40 DUNG DỊCH
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG VI – BÀI 41 ĐỘ TAN CỦA MỘT CHẤT TRONG NƯỚC
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG VI – BÀI 42 NỒNG ĐỘ DUNG DỊCH
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG VI – BÀI 43 PHA CHẾ DUNG DỊCH
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG VI – BÀI 44 BÀI LUYỆN TẬP 8
- GIẢI BÀI TẬP HÓA 8 SÁCH GIÁO KHOA – CHƯƠNG VI – BÀI 45 BÀI THỰC HÀNH 7
Bài 22: Tính theo phương trình hóa học
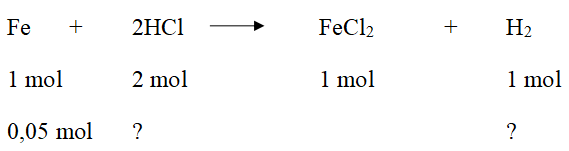
Bài 1: Sắt tác dụng với axit clohiđric : Fe + 2HCl → FeCl2 + H2↑.
Nếu có 2,8g sắt tham gia phản ứng em hãy tìm:
a) Thể tích khí hiđro thu được ở đktc.
b) Khối lượng axit clohiđric cần dùng.
Lời giải:
a) PTPU
nFe = 2,8/56 = 0,05 (mol);
Theo pt: nH2 = nFe = 0,05 (mol)
VH2 = 22,4.n = 22,4.0,05 = 1,12 (l)
b) nHCl = 2.nFe = 2. 0,05 = 0,1 (mol)
mHCl = M.n = 0,1.36,5 = 3,65 (g)
Bài 2: Lưu huỳnh (S) cháy trong không khí sinh ra chất khí mùi hắc, gây ho đó là lưu huỳnh đioxit (khí sunfurơ) có công thức hóa học là SO2.
a) Viết phương trình hóa học của lưu huỳnh cháy trong không khí.
b) Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6g. Hãy tìm.
-Thể tích khí sunfurơ sinh ra ở đktc.
-Thể tích không khí cần dùng ở đktc. Biết oxi chiếm 1/5 thể tích không khí.
Lời giải:
a) Phương trình hóa học S + O2 
b) nS = 1,6/32 = 0,05 mol.
Theo phương trình trên, ta có:
nSO2 = nS = nO2 = 0,05 mol.
⇒ VSO2 = 0,05 .22,4 = 1,12 l.
⇒ VO2 = 22,4.0,05 = 1,12 l
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần là
⇒ Vkk = 5VO2 = 5.1,12 = 5,6 l
Bài 3: Có phương trình hóa học sau:
CaCO3 → Cao + CO2.
a) Cần dùng bao nhiêu mol CaCO3 để điều chế được 11,2g CaO?
b) Muốn điều chế được 7g CaO cần dùng bao nhiêu gam CaCO3?
c) Nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra bao nhiêu lít CO2 (đktc).
d) Nếu thu được 13,44 lít khí CO2 ở đktc thì có bao nhiêu gam chất rắn tham gia và tạo thành sau phản ứng.
Lời giải:
Phương trình hóa học CaCO3 → CaO + CO2.
a) nCaO = 11,2/56 = 0,2 mol.
Theo PTHH thì nCaCO3 = nCaO = 0,2 (mol) ⇒ mCaCO3 = 0,2 . 100 = 20g
b) nCaO = 7/56 = 0,125 (mol)
Theo PTHH thì nCaCO3 = nCaO = 0,125 (mol)
mCaCO3 = M.n = 100.0,125 = 12,5 (g)
c) Theo PTHH thì nCO2 = nCaCO3 = 3,5 (mol)
VCO2 = 22,4.n = 22,4.3,5 = 78,4 (g)
d) nCO2 = 13,44/22,4 = 0,6 (mol)
Theo PTHH nCaO = nCaCO3 = nCO2 = 0,6 (mol)
mCaCO3 = n.M = 0,6.100 = 60 (g)
mCaO = n.M = 0,6.56 = 33,6 (g)
Bài 4: a) Cacbon oxit CO tác dụng với khí oxi tạo ra cacbon đioxit. Hãy viết phương trình hóa học.
b) Nếu muốn đốt cháy 20 ml CO thì phải dùng bao nhiêu mol O2 để sau phản ứng người ta chỉ thu được một chất khí duy nhất?
c) Hãy điền vào những ô trống số mol các chất phản ứng và sản phẩm có ở những thời điểm khác nhau. Biết hỗn hợp CO và O2 ban đầu được lấy đúng tỉ lệ về số mol các chất theo phương trình hóa học.
Lời giải:
a) Phương trình phản ứng:
2CO + O2 → 2CO2
b Theo phương trình nO2 = (1/2)nCO = 20.1/2 = 10 (mol)
c Hoàn chỉnh bảng
Thời điểm t1 nCO còn 15mol ⇒ nCO đã phản ứng = 20 – 15= 5mol
Theo pt nCO2 = nCO(pư) = 5 mol
nO2pư = (1/2).nCO(pư) = (1/2).5 = 2,5 mol ⇒ nO2 còn lại = 10 – 2,5 = 7,5 mol
Tương tự tính thời điểm t2 và thời điểm t3 ta được số liệu sau:
| Số mol | |||
| Các thời điểm | Các chất phản ứng | Sản phẩm | |
| CO | O2 | CO2 | |
| Thời điểm ban đầu t0 | 20 | 10 | 0 |
| Thời điểm t1 | 15 | 7,5 | 5 |
| Thời điểm t2 | 3 | 1,5 | 17 |
| Thời điểm kết thúc t3 | 0 | 0 | 20 |
Bài 5: Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A.
Biết rằng:
– Khí A có tỉ lệ khối đối với không khí là 0,552.
– Thành phần theo khối lượng của khí A là: 75% C và 25% H.
Các thể tích khí đo ở đktc.
Lời giải:
dA/kk = 0,552 ⇒ Khối lượng mol của khí A: 29.0,552 = 16 (g)
Đặt CTHH của khí A là CxHy
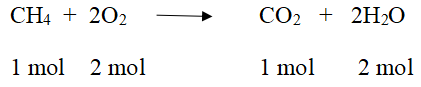
Công thức hóa học của khí A là: CH4
PTPỨ:
Tỉ lệ số mol cũng chính là tỉ lệ thể tích.
Theo phương trình nO2 = 2.nCH4 ⇒ VO2 = 2.VCH4 = 2.11,2 = 22,4(l)