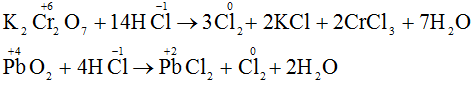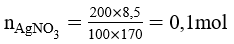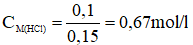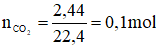- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 1 THÀNH PHẦN NGUYÊN TỬ
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 2 HẠT NHÂN NGUYÊN TỬ – NGUYÊN TỐ HÓA HỌC – ĐỒNG VỊ
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 3 LUYỆN TẬP: THÀNH PHẦN NGUYÊN TỬ
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 4 CẤU TẠO NGUYÊN TỬ
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 5 CẤU HÌNH ELECTRON
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG I – BÀI 6 LUYỆN TẬP: CẤU TẠO VỎ NGUYÊN TỬ
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 7 BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 11: LUYỆN TẬP : BẢNG TUẦN HOÀN, SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ VÀ TÍNH CHẤT CỦA CÁC NGUYÊN TỐ HÓA HỌC
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 8 SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ HÓA HỌC
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG II – BÀI 10 Ý NGHĨA CỦA BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 12 LIÊN KẾT ION – TINH THỂ ION
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 13 LIÊN KẾT CỘNG HÓA TRỊ
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 14 TINH THỂ NGUYÊN TỬ VÀ TINH THỂ PHÂN TỬ
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 15 HÓA TRỊ VÀ SỐ OXI HÓA
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 17 PHẢN ỨNG OXI HÓA KHỬ
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG III – BÀI 16 LUYỆN TẬP: LIÊN KẾT HÓA HỌC
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 18 PHÂN LOẠI PHẢN ỨNG TRONG HÓA HỌC VÔ CƠ
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 19 LUYỆN TẬP: PHẢN ỨNG OXI HÓA – KHỬ
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 21 KHÁI QUÁT VỀ HALOGEN
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 22 CLO
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG IV – BÀI 20 BÀI THỰC HÀNH SỐ 1- PHẢN ỨNG OXI HÓA KHỬ
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 23 HIDRO CLORUA – AXIT CLOHIDRIC VÀ MUỐI CLORUA
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 24 SƠ LƯỢC VỀ HỢP CHẤT CÓ OXI CỦA CLO
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 25 FLO – BROM – IOT
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 26 LUYỆN TẬP NHÓM HALOGEN
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 27 BÀI THỰC HÀNH 2: TÍNH CHẤT HÓA HỌC KHÍ CLO VÀ HỢP CHẤT CỦA CLO
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG VI – BÀI 29 OXI – OZON
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG VI – BÀI 30 LƯU HUỲNH
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG V – BÀI 28 BÀI THỰC HÀNH SỐ 3: TÍNH CHẤT HÍA HỌC CỦA BROM VÀ IOT
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG VI – BÀI 31: BÀI THỰC HÀNH SỐ 4. TÍNH CHẤT CỦA OXI, LƯU HUỲNH
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG VI – BÀI 32 HIDRO SUNFUA – LƯU HUỲNH DIOXIT – LƯU HUỲNH TRIOXIT
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG VI – BÀI 33 AXIT SUNFURIC – MUỐI SUNFAT
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG VI – BÀI 34 LUYỆN TẬP : OXI VÀ LƯU HUỲNH
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG VI – BÀI 35 BÀI THỰC HÀNH SỐ 5. TÍNH CHẤT CÁC HỢP CHẤT CỦA LƯU HUỲNH
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG VII – BÀI 36 TỐC ĐỘ PHẢN ỨNG HÓA HỌC
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG VII – BÀI 37 BÀI THỰC HÀNH SỐ 6. TỐC ĐỘ PHẢN ỨNG HÓA HỌC
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG VII – BÀI 38 CÂN BẰNG HÓA HỌC
- GIẢI BÀI TẬP HÓA 10 SÁCH GIÁO KHOA – CHƯƠNG VII – BÀI 39 LUYỆN TẬP : TỐC ĐỘ PHẢN ỨNG HÓA HOC
Bài 23: Hiđro clorua – Axit clohiđric và muối clorua
Bài 1 (trang 106 SGK Hóa 10): Cho 20g hỗn hợp bột Mg và Fe tác dụng với dung dịch HCl dư thấy có 1g khí H2 bay ra. Khối lượng muối clorua tạo ra trong dung dịch là bao nhiêu gam?
A. 40,5g.
B. 45,5g.
C. 55,5g.
D. 65,5g.
Lời giải:
C đúng
nH2 = 1/2 =0,5 mol.
Mg + 2HCl → MgCl2 + H2
Fe + 2HCl → FeCl2 + H2
nMg = x; nFe = y.
nH2 = x + y = 0,5 mol.
mhh = 24x + 56y = 20g.
Giải hệ phương trình ta có x = y =0,25 mol.
mMgCl2 = 0, 25 × 95 = 23,75g.
mFeCl2 = 0,25 × 127 = 31,75g
Khối lượng muối clorua = 23,75 + 31,75= 55,5
Bài 2 (trang 106 SGK Hóa 10): Nêu những tính chất vật lí của khí hiđro clorua HCl.
Lời giải:
Hiđro clorua là chất khí không màu, mùi xốc, nặng hơn không khí, khí hiđro clorua tan nhiều trong nước tạo thành dung dịch axit, ở 20oC một thể tích nước hòa tan 500 thể tích hiđro clorua.
Bài 3 (trang 106 SGK Hóa 10): Có các chất sau: axit sunfuric đặc, nước, kali clorua rắn. Hãy viết các phương trình phản ứng để điều chế hidro clorua.
Lời giải:
Phương trình hóa học của phản ứng điều chế hidro clorua
2NaCltinh thể + H2SO4 đđ –to→ Na2SO4 + 2HCl
2KCl + 2H2O –đpdd có m.ngăn→ 2KOH + H2 + Cl2
H2 + Cl2 –as→ 2HCl.
Bài 4 (trang 106 SGK Hóa 10): Hãy dẫn ra những phản ứng hóa học của axit clohiđric để làm thí dụ.
a) Đó là những phản ứng oxi hóa – khử.
b) Đó không phải là phản ứng oxi hóa – khử.
Lời giải:
a) Những ví dụ phương trình phản ứng hóa học của axit clohidric là phản ứng oxi hóa – khử:
Với vai trò là chất khử:
Với vai trò là chất oxi hóa :
Mg + 2HCl → MgCl2 + H2
b) Những ví dụ phương trình phản ứng hóa học của axit clohidric là không phải là phản ứng oxi hóa – khử:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
CuO + 2HCl → CuCl2 + H2O.
Bài 5 (trang 106 SGK Hóa 10): Bản chất của các phản ứng điều chế hiđro clorua bằng phương pháp sunfat và phương pháp tổng hợp khác nhau như thế nào? Các phương pháp trên đã dựa vào những tính chất hóa học nào của các chất tham gia phản ứng?
Lời giải:
Bản chất của phương pháp sunfat là dùng phản ứng trao đổi.
NaCl + H2SO4 → NaHSO4 + HCl.
Bản chất của phương pháp tổng hợp là dùng phương pháp hóa hợp (phản ứng oxi hóa – khử).
H2 + Cl2 → 2HCl.
Bài 6 (trang 106 SGK Hóa 10): Sục khí Cl2 đi qua dung dịch Na2CO3 thấy có khí CO2 thoát ra. Hãy viết phương trình hóa học của các phản ứng đã xảy ra.
Lời giải:
Cl2 + H2O ⇆ HCl + HClO
2HCl + Na2CO3 → 2NaCl + CO2↑ + H2O.
Bài 7 (trang 106 SGK Hóa 10): Tính nồng độ của hai dung dịch axit clohiđric trong các trường hợp sau:
a) Cần phải dùng 150ml dung dịch HCl để kết tủa hoàn toàn 200g dung dịch AgNO3 8,5%.
b) Khi cho 50g dung dịch HCl vào một cốc đựng NaHCO3 (dư) thì thu được 2,24 lít khí ở đktc.
Lời giải:
a)
Phương trình hóa học của phản ứng:
HCl + AgNO3 → AgCl + HNO3
Theo pt nHCl = nAgCl = 0,1 mol
b)
Phương trình hóa học của phản ứng:
HCl + NaHCO3 → NaCl + CO2↑ + H2O
Theo pt: nHCl = nCO2 = 0,1 mol ⇒ mHCl = 0,1. 36,5 = 3,65 g