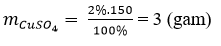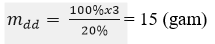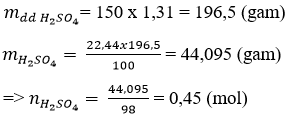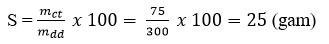- Đề kiểm tra 15 phút Hóa học 8 Chương 1 (Đề 1)
- Đề kiểm tra 15 phút Hóa học 8 Chương 1 (Đề 2)
- Đề kiểm tra 15 phút Hóa học 8 Chương 1 (Đề 3)
- Đề kiểm tra 15 phút Hóa học 8 Chương 1 (Đề 4)
- Đề kiểm tra 15 phút Hóa học 8 Chương 1 (Đề 5)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 1 (Đề 1)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 1 (Đề 2)
- Đề kiểm tra 15 phút Hóa học 8 Chương 2 (Đề 1)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 1 (Đề 3)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 1 (Đề 4)
- Đề kiểm tra 15 phút Hóa học 8 Chương 2 (Đề 2)
- Đề kiểm tra 15 phút Hóa học 8 Chương 2 (Đề 3)
- Đề kiểm tra 15 phút Hóa học 8 Chương 2 (Đề 4)
- Đề kiểm tra 15 phút Hóa học 8 Chương 2 (Đề 5)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 2 (Đề 1)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 2 (Đề 2)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 2 (Đề 4)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 2 (Đề 5)
- Đề kiểm tra 15 phút Hóa học 8 Chương 3 (Đề 1)
- Đề kiểm tra 15 phút Hóa học 8 Chương 3 (Đề 2)
- Đề kiểm tra 15 phút Hóa học 8 Chương 3 (Đề 3)
- Đề kiểm tra 15 phút Hóa học 8 Chương 3 (Đề 4)
- Đề kiểm tra 15 phút Hóa học 8 Chương 3 (Đề 5)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 3 (Đề 1)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 3 (Đề 2)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 3 (Đề 3)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 3 (Đề 4)
- Đề kiểm tra Học kì 1 Hóa học lớp 8 (Đề 1)
- Đề kiểm tra Học kì 1 Hóa học lớp 8 (Đề 2)
- Đề kiểm tra Học kì 1 Hóa học lớp 8 (Đề 4)
- Đề thi hóa 8 học kì 1 (Đề 1)
- Đề thi hóa 8 học kì 1 (Đề 2)
- Đề thi hóa 8 học kì 1 (Đề 3)
- Đề thi hóa 8 học kì 1 (Đề 4)
- Đề kiểm tra 15 phút Hóa học 8 Chương 4 (Đề 1)
- Đề kiểm tra 15 phút Hóa học 8 Chương 4 (Đề 2)
- Đề kiểm tra 15 phút Hóa học 8 Chương 4 (Đề 3)
- Đề kiểm tra 15 phút Hóa học 8 Chương 4 (Đề 4)
- Đề kiểm tra 15 phút Hóa học 8 Chương 4 (Đề 5)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 4 (Đề 1)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 4 (Đề 2)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 4 (Đề 3)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 4 (Đề 4)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 4 (Đề 5)
- Đề kiểm tra 15 phút Hóa học 8 Chương 5 (Đề 1)
- Đề kiểm tra 15 phút Hóa học 8 Chương 5 (Đề 2)
- Đề kiểm tra 15 phút Hóa học 8 Chương 5 (Đề 3)
- Đề kiểm tra 15 phút Hóa học 8 Chương 5 (Đề 4)
- Đề kiểm tra 15 phút Hóa học 8 Chương 5 (Đề 5)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 5 (Đề 1)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 5 (Đề 3)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 5 (Đề 4)
- Đề kiểm tra 15 phút Hóa học 8 Chương 6 (Đề 1)
- Đề kiểm tra 15 phút Hóa học 8 Chương 6 (Đề 2)
- Đề kiểm tra 15 phút Hóa học 8 Chương 6 (Đề 3)
- Đề kiểm tra 15 phút Hóa học 8 Chương 6 (Đề 4)
- Đề kiểm tra 15 phút Hóa học 8 Chương 6 (Đề 5)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 6 (Đề 1)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 6 (Đề 2)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 6 (Đề 3)
- Đề kiểm tra 1 tiết Hóa học 8 Chương 6 (Đề 4)
- Đề thi hóa 8 học kì 2 (Đề 1)
- Đề thi hóa 8 học kì 2 (Đề 2)
- Đề thi hóa 8 học kì 2 (Đề 3)
- Đề thi hóa 8 học kì 2 (Đề 4)
- Đề thi hóa 8 học kì 2 (Đề 5)
Đề kiểm tra 1 tiết Hóa học 8 Chương 6 (Đề 4)
Đề kiểm tra 1 tiết Hóa học 8 Chương 6 (Đề 4)
Lớp học thêm toán thầy Trường tổng hợp tại Hà Nội ( học thêm toán Edusmart tổng hợp, Edusmart mở lớp học thêm toán 12, lớp học thêm toán 11 , lớp học thêm toán 10, luyện thi vào 10 , lớp học thêm toán 9, lớp học thêm toán 8, lớp học thêm toán 7, lớp học thêm toán 6)
Câu 1: Hãy trình bày cách pha chế 150 gam dung dịch CuSO4 2% từ dung dịch CuSO4 20%.
Câu 2: Cho 150ml dung dịch H2SO4 22,44% (D = 1,31g/ml). Tính số mol của H2SO4 có trong dung dịch trên.
Câu 3: Ở 30ºC, hòa tan 75 gam muối CuSO4.5H2O vào 300 gam nước thì thu được dung dịch bão hòa. Hãy tính độ tan của muối CuSO4.5H2O ở nhiệt độ đó.
Câu 4: Trong 500ml dung dịch Z có chứa 8,4 gam KOH.
a) Tính nồng độ mol của dung dịch Z.
b) Phải thêm bao nhiêu ml nước vào 300ml dung dịch Z để được dung dịch KOH 0,1M?
Đáp án và hướng dẫn giải
Câu 1: Khối lượng CuSO4 có trong 150 gam dung dịch CuSO4 2% là:
Khối lượng dung dịch H2SO4 20% có chứa 3 gam CuSO4 là:
Khối lượng nước cần dùng để pha chế:
mH2O= 150 – 15 = 135 (gam)
* Cách pha chế: Cân lấy 15 gam dung dịch CuSO4 20%, sau đó đổ 135 gam nước vào cốc đựng dung dịch CuSO4 nói trên. Khuấy đều, ra thu được 150 gam dung dịch CuSO4 2%.
Câu 2: Ta có:
Câu 3: Độ tan của muối CuSO4.5H2O ở 30ºC là:
Câu 4:
Tính CMKOH:
Ta có: nKOH = 8,4/56 = 0,15 (mol)
→ CMKOH = 0,15/0,5 = 0,3M.
Tính VH2O phải thêm:
Vì khi pha loãng dung dịch thì số mol chất tan không đổi nên:
nKOH ban đầu = nKOH lúc sau
Gọi V là thể tích dung dịch sau khi pha loãng.
Ta có: V = n/CM = 0,15/0,1 = 1,5 (lít) = 1500 (ml)
Vậy thể tích nước cần thêm vào là:
1500 – 500 = 1000 (ml).